管理體系認證咨詢
- SA8000社會責任管理體
- iso50001能源管理體
- ISO14020環境標志產
- TS16949|IATF1
- ISO22000食品安全管
- ISO45001職業健康與
- ISO14001環境管理體
- ISO9001質量管理體系
- ISO/IEC 27001
- ISO/IEC 20000
- ISO22301業務連續性
- 系統集成資質
- ISO55001資產管理體
- ISO/TS22163國際
- GB/T50430建筑施工
- ISO13485醫療器械質
- 歐盟CE認證|CE證書查詢
- GBT29490-2013
- 三體系認證
- REACH/ROHS檢測報
- 全球回收標準grs認證
- brc認證_英國零售商協會
- CMMI軟件能力成熟度集成
- AAA級企業信用等級證書|
- GB/T 31950-20
- ISO37001反賄賂管理
- REACH|ROHS認證|
- CCC|3C認證|CCC認
- ISO22716(GMPC
- TS16949|IATF1
- iso28000供應鏈安全
- ISO10012測量管理體
- GB/T 39001-20
- ISO20252市場研究行
- ISO 29990職業教育
- 美國FDA注冊_醫療器械_
- ISO29151個人身份信
- ISO27701隱私信息管
- ISO27018公有云個人
- ISO27017云服務信息
- ISO14064碳排放認證
- ISO14067產品碳足跡
- ISO41001設備設施管
聯系方式

上海奔爍咨詢公司
TEL: 4006-010-725
(上海) 電話|微信: 152-2175-9315
Q Q 客服: 2215501312
(青島) 電話|微信: 137-9194-1216
Q Q 客服: 1263118282
(北京) 電話|微信: 136-8120-0268
Q Q 客服: 2970890153
(杭州) 電話|微信: 158-6716-8335
Q Q 客服: 2668763939
(西安) 電話|微信: 139-0928-9277
Q Q 客服: 3568192523
(深圳) 電話|微信: 130-7782-9315
Q Q 客服: 574472821
美國FDA注冊_醫療器械_化妝品_酸化/低酸罐藏食品(FCE/SID)
美國FDA擴大EUA(緊急使用授權)范圍,更多口罩可作為醫療口罩進入美國
文章錄入:上海奔爍咨詢 | 文章來源:FDAImports | 添加時間:2020-4-14

3月24日,美國FDA發布了關于擴大緊急使用授權(Emergency Use Authorization ,簡稱EUA)范圍的指導文件,將EUA擴展至“進口的、非NIOSH批準的一次性過濾口罩(FFR),這些口罩應當是經過驗證、符合特定性能的標準,或在某些國家已經獲得了營銷許可”。
高級律師Ben England 對此解釋道,“這樣一來,那些通常情況下不能用于醫療用途的非醫用工業口罩現在則有可能可以作為醫用口罩,并進口到美國市場。” 目前FDA似乎沒有要求這類器械進行FDA注冊和產品列名,不過這一點之后可能會發生變化。然而,FDA希望制造商能夠做到:在自己網站上發布產品的英文信息(如使用方法、適應癥等);保證標簽標識符合CDC的要求;給醫院和診所寫信并附上使用說明和免責聲明等。
關于FDA發布的這封EUA通知,請看鏈接:https://www.fda.gov/media/136403/download
下面我們總結歸納了這封EUA通知的主要內容,并簡要解釋了口罩生產商和進口商接下來需要如何做才能符合EUA授權的要求。無論如何,這對每個人來說都是一個好消息,不過企業接下來仍需要完成一些重要和詳細的步驟和工作。
符合本次EUA授權的口罩(respirator)
1. 經過設計、評估和驗證后,符合既定的性能標準,并具有相應可接受產品類別的一次性過濾口罩(FFRs)如下:
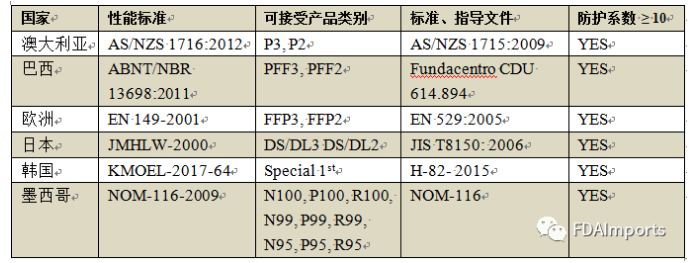
2. 具備下列其中一個監管機構營銷授權的一次性過濾口罩:
歐盟CE認證
澳大利亞ARTG(Australian Register of Therapeutic Goods)準入證書
加拿大衛生部許可(Health Canada License)
日本的PMDA(Pharmaceuticals and Medical Device)或 MHLW(Ministry of Health Labour and Welfare)許可
企業應當如何做?
口罩生產商或者進口商必須向美國FDA以電子郵件形式提出申請,表明他們計劃進口非NIOSH批準的一次性口罩符合上述1和/或2的條件。為使FDA判斷生產商或進口商所申請的一次性口罩是否列入EUA授權的口罩列表,生產商或進口商申請授權的電子郵件應該當包含以下信息:
詳細列出生產商、產品型號、其他監管機構或者認證機構出具的營銷授權或證書,合格證書(如果有的話)、產品所適用的性能標準,以及其他適用的指導文件;
大致估算一下在這次緊急公眾衛生事件期間所要進口的口罩數量;
產品標簽的副本。口罩必須至少符合本次EUA條件中condition A和condition B(見下文)的標簽標識要求;
一旦收到上述信息和其他符合上述類別的附加信息,FDA便會對這些進口一次性口罩的適用性進行確認,然后再會回復生產商和進口商的電子郵件,通知生產商的口罩獲得EUA授權,被列入Exhibit 1。
EUA授權條件(Conditions):
獲得EUA授權的口罩生產商或進口商仍需要進行一些附加步驟。生產商需要完成以下步驟,并告知FDA。
獲得EUA授權的口罩生產商:
Condition A - 獲EUA授權的口罩生產商需要在其網站上以英文形式公布所有授權口罩型號的預期使用用途和其他說明(如擬合度測試等)。除此之外,生產商必須將網站地址以郵件形式告知FDA,表示已經符合這項要求。FDA將會通過EUA網站(https://www.fda.gov/medical-devices/emergency-situations-medical-devices/emergency-use-authorizations#covid19ppe.)向公眾公開這項信息。如果網站地址如有任何變動,生產商必須及時通知FDA。
Condition B - 生產商必須準備一封英文信函,該信函需要發給每個接收授權口罩的終端客戶(如醫院等)。該信函內容必須包括授權口罩的生產商、型號、預期用途、生產商網站(如有)等。
Condition C - 獲得授權的口罩生產商應將EUA的條款和條件通知給進口商(如有),并確保接收授權口罩的終端客戶(如每家醫院等)也收到Condition B所要求的信息。
Condition D - 獲得授權的口罩生產商將有一個合適的流程來報告他們知道的不良事件,并將這些報告發送給FDA(該項是一個要求。制造商必須服從)。
Condition E - 針對在美國所使用的授權口罩,其所有描述性印刷材料應符合美國CDC在COVID-19爆發期間的相關提議,以及此次EUA中的相關規定。(該項不需要直接向FDA報告,只要制造商(或進口商)確保能完成即可。這只是Condition B的延伸。)
Condition F - 針對在美國所使用的授權口罩,其所有說明性印刷材料都不能明確表明或暗示該產品對預防COVID-19是安全或有效的。(該項不需要直接向FDA報告,只要制造商(或進口商)確保能完成即可。這只是Condition A、B、E的延伸。)
Condition G - 授權口罩的生產商應當保存所有跟EUA相關的記錄,直到FDA另行通知。根據要求,這些記錄將會用于FDA審查。(再次聲明,該項不需要直接向FDA報告,他們只需要保留所有Condition A至F的合規記錄,以及出口到美國的記錄文件。)
獲得授權的口罩進口商:
Condition H - 針對在美國所使用的授權口罩,其所有描述性印刷材料應與美國CDC在COVID-19爆發期間的建議一致,并與本EUA中規定的條件一致。(重復Condition E)
Condition I - 任何與授權口罩使用相關的描述材料都不能明確表明或暗示該產品對預防COVID-19是安全或有效的。(重復Condition F)
Condition J - 授權口罩的進口商將通知生產商關于本次EUA的條款和條件,并確保終端客戶(如醫院等)在接收授權口罩產品的同時,也能收到Condition B 所需的信息。(本條與Condition C是互惠的,如果進口商能夠協助生產商的話,則實施起來并不困難。)
Condition K - 在本次緊急公共衛生事件結束前,授權口罩的進口商需保留所有跟本次EUA相關的記錄。(進口商版的Condition G)
【返回 】
